La tabla periódica: algo más que un icono de
la ciencia.
La
tabla periódica (TP) es uno de los iconos más relevantes y universales de la
ciencia moderna. Probablemente cualquier persona que haya cursado educación
secundaria es capaz de recordar que constituye una clasificación de los
elementos químicos. A veces, se rememora con cierto desagrado, como un
ejercicio de memorización estéril acompañado de unos “misteriosos” números
denominados “valencias”. Para quien ha profundizado algo más, en bachillerato,
en estudios universitarios, o con lecturas sobre temas científicos, es fácil
que la identifique como una herramienta de gran utilidad y con una historia
curiosa para su construcción. En este capítulo se muestra brevemente qué
significa, por qué es importante y cómo sirve para ordenar los elementos
químicos de los que está hecho todo: el aire, nuestro cuerpo, las flores… Una
idea que se intenta transmitir es que es mucho más que un icono; es un ejemplo
de cómo se desarrolla la ciencia, fruto de una labor colectiva de personas de
muy diversos países y generaciones. Además, se explicará que la construcción de
la TP y sus aplicaciones no incumben únicamente a la química, sino también a
otras ciencias. Por otra parte, es un logro científico donde la labor del
profesorado de las distintas etapas educativas ha sido primordial.
Celebración en 2019 del Año Internacional de la Tabla Periódica de los Elementos Químicos.
En
diciembre de 2017 la Asamblea General de
Naciones Unidas proclamó 2019 como Año
Internacional de la Tabla Periódica de los Elementos Químicos, culminando
así una iniciativa promovida a través de la UNESCO y de Rusia. La idea surgió
del investigador, profesor y divulgador inglés Martyn Polyakoff (de madre
inglesa y padre ruso), que se lo sugirió a la profesora rusa Natalia Tarasova,
presidenta de la Unión Internacional de
Química Pura y Aplicada (IUPAC). El objetivo es conmemorar el 150º
aniversario de la propuesta de ordenación de los elementos químicos conocidos
entonces, en forma de tabla, por el ruso Dimitri Ivánovich Mendeléiev, así como
el 100º aniversario de la creación de la propia IUPAC. Con la efeméride, se
reconoce la importancia de las ciencias básicas en el desarrollo sostenible y
en la solución de problemas globales (energía, educación, agricultura, salud…).
Durante
todo el año 2019 se están llevando a cabo, a nivel mundial, multitud de
acciones y actividades en torno a este tema [1]. Por ejemplo, en España, se ha
emitido un sello que complementa al diseñado en 2007 por el centenario de la
muerte de Mendeléiev [2]. Ambos sellos se recogen en la Fig. 1.
Fig.1. Sellos sobre la
tabla periódica (imágenes cedidas por la S.E. Correos y Telégrafos S.A.).
Los elementos químicos.
La noción de elemento químico es un
aspecto central de la química y para entender la utilidad de la TP. Para
algunos filósofos presocráticos todos los cuerpos estaban compuestos por cuatro
constituyentes fundamentales (tierra, aire, fuego y agua), en distinta
proporción, a los que Aristóteles añadiría un “quinto elemento” muy sutil, el
éter, formador de la esfera celeste, que aún se rememora cuando se habla de la
“quintaesencia” (lo más puro, fino y acendrado de una cosa, según la RAE).
Clasificaciones análogas forman parte de la tradición de las grandes culturas
asiáticas. En el siglo XVI, el alquimista y médico suizo Paracelso propuso que
había tres “principios fundamentales” (sal, mercurio y azufre) que hoy en día
se pueden entender como propiedades (solidez, fluidez y combustibilidad), más
que como ingredientes fundamentales de la materia1. En todo caso, es
en el siglo XVII cuando el anglo-irlandés Robert Boyle establece que la materia
está formada por “ciertos cuerpos primitivos y simples” que componen los
“cuerpos mixtos”, en su obra The
Sceptical Chymist (1661), y propone que un elemento (“cuerpo simple”) es
una sustancia que no puede reducirse (“ser analizada”) a otra más sencilla. El
francés Antoine-Laurent de Lavoisier, en su Traité
Élémentaire de Chimie (1789), reforzó este concepto, postulando que
“sustancia simple” es la que no se puede descomponer en otras por
procedimientos químicos. Algunas de sus sustancias (en total 33), como la luz y
el calórico hoy no se consideran elementos y otras, como la cal, son
compuestos.
El
inglés John Dalton, que con el tiempo serviría para denominar a la alteración
en la capacidad de distinguir los colores (daltonismo) que estudió en él mismo,
recuperó la teoría atomista de los griegos para explicar la composición de la
materia. En 1808 explicó en A New System
of Chemical Philosophy que las propiedades específicas de los elementos
derivan de sus átomos constituyentes, que se podían visualizar como pequeñas
esferas. Su teoría sugería que los átomos de distintos elementos poseen
diferente masa y que se combinan para formar compuestos en proporciones de números
enteros sencillos (1:1, 1:2, 2:3…). Fue de los primeros en determinar los pesos
atómicos, labor que perfeccionó el sueco Jöns Jacob Berzelius
y, de forma más concluyente, el italiano Stanislao Cannizzaro, quien distinguió
entre pesos moleculares y atómicos2 y que protagonizaría el Congreso
de Karlsruhe (Alemania), reunión internacional de química, celebrada en 1860,
donde se puso de manifiesto que existían ciertas regularidades en las
propiedades de los elementos químicos. Desde entonces, hasta el primer tercio
del siglo XX, se fue descubriendo cada vez más sobre la constitución de los
átomos y se entendió que consisten en pequeños núcleos formados por protones
(carga positiva) y neutrones (carga neutra) rodeados de electrones (carga
negativa y de mucha menor masa) [3]. La idea actual de elemento químico es que
se trata de la sustancia que no se puede descomponer en otras más simples por
métodos químicos y que está formada por átomos del mismo tipo que, al
combinarse entre sí, forman compuestos [4].
La construcción de la tabla periódica:
introducción histórica.
Para
simplificar y racionalizar el estudio de la química de los elementos químicos,
hubo múltiples intentos de clasificarlos en función de sus propiedades y pesos
atómicos a lo largo del siglo XIX [5-8]. Son emblemáticas las “triadas” del
alemán Johann Wolfgang Döbereiner, que clasificó en 1829 los elementos, por
propiedades químicas similares, en grupos de tres (como calcio, estroncio y
bario) y advirtió que, en cada triada,
el peso atómico de uno era la media aritmética de los otros dos
aproximadamente. El geólogo francés Alexandre Émile Béguyer de Chancourtois, en
1862, colocó los elementos conocidos (y algunos compuestos)por orden creciente
de peso atómico, sobre una curva helicoidal inscrita alrededor de un cilindro
vertical con una circunferencia de 16 unidades (peso atómico del oxígeno), en
la que los elementos que caían en la misma vertical tenían propiedades
semejantes. Sugirió una ordenación que denominó vis tellurique (tornillo telúrico), por estar el telurio en el
centro de la gráfica. Para Scerri, aunque Chancourtois recibió poca atención en
su tiempo, fue quien realmente descubrió la periodicidad química [6].
En
1865, el químico inglés John Alexander Reina Newlands3 apreció
que cuando los elementos se ordenaban por pesos atómicos crecientes, cada ocho
elementos existían semejanzas en las propiedades físicas y químicas (Fig. 2).
Como señaló en ello cierto parecido con la escala musical, propuso que se
podría denominar, “de forma provisional”, como “Ley de las octavas” que fue
ridiculizada pero, años después, fue reconocida.
Fig.2. Fotografía de
Newlands y la tabla de “octavas” que publicó en Chemical News (1865). Señaló: “donde
dos elementos tienen el mismo equivalente, ambos se designan por el mismo
número”.
De
forma independiente, dos asistentes al Congreso de Karlsruhe, Mendeléiev y el
alemán Julius Lothar Meyer (menos conocido en su tiempo), establecieron que
existe una ley periódica, por la que las propiedades de los elementos (unos 60
entonces) se repiten con cierta periodicidad al aumentar su peso atómico. La
tabla de Meyer está fechada en diciembre de 1868, pero no se publicó hasta
1870, mientras que la de Mendeléiev fue comunicada por Menshutkin (por
enfermedad del autor), en octubre de 1868, a las Sociedad Rusa de Química y se
publicó en 1869 (Fig. 3). Mendeléiev fue más consciente de la importancia de su
clasificación, que fue modificando durante las cuatro décadas siguientes.
Fig.3. Fotografía de
Mendeléiev y su tabla de 63 elementos publicada en la revista alemana
Zeitschrift fϋr Chemie (1869).
Visto
siglo y medio después resulta admirable la intuición de Mendeléiev,
considerando la inexactitud de muchos de los datos de que disponía. De su tabla
se deducía una periodicidad de las propiedades, referidas esencialmente a las
proporciones con las que se combinaban los elementos, y que dependían, a su
juicio, de los pesos atómicos. Lo más relevante es que predijo la existencia de
elementos que se descubrirían después, como el galio (ekaaluminio) y el germanio (ekasilicio),
y que cambiara el orden en algún par de elementos [9].
Gracias
a la TP de Mendeléiev y otras como las comentadas, se pudieron relacionar las
propiedades de los elementos y sus compuestos con otros de comportamiento
similar, lo que sirvió de impulso para la racionalización de la química. Su
tabla supuso un verdadero renacimiento de esta ciencia y se considera que
varios descubrimientos posteriores tienen su base en la búsqueda de las causas
de las irregularidades que señaló. Entre los problemas estaban, como se ha
comentado, los “huecos” de elementos y algunas inversiones de orden, como
telurio-yodo, que en un principio justificó por errores en el cálculo de pesos
atómicos. Estas inversiones se explicarían en 1913, como otros aspectos
esenciales de la TP, por el físico inglés Henry Gwyn Jeffreys Moseley4,
al justificar el concepto de número atómico, mediante la ley que lleva su
nombre, que establece la relación empírica entre la longitud de onda de rayos X
emitidos por los átomos, con su número atómico (Fig. 4). Fue la base para
establecer la “ley periódica” moderna, según la cual, las propiedades físicas y
químicas de los elementos muestran tendencias periódicas al ponerlos en orden
por número atómico (y no del peso atómico, como la primitiva ley periódica de
Mendeléiev).
Fig.4. Moseley en el
laboratorio Balliol-Trinity de la Universidad de Oxford (1910) y la representación
de la raíz cuadrada de las frecuencias de emisión de rayos X de los elementos
en relación a su número atómico, publicada en Philosophical Magazine (1914).
Las
aportaciones de Mendeléiev, Meyer y otros científicos del siglo XIX, en la
construcción de la TP, se acrecientan si se considera que, en su época, no se
conocía la estructura de la materia a nivel atómico, y que la separación y la
purificación de los elementos eran rudimentarias. Estos autores se solían
referir a un “sistema periódico”, término que permanece aún en idiomas como el
alemán (periodensystem) si bien, con
el tiempo, se fue denominando “tabla periódica” en otros como inglés (periodic table), francés (tableau o table périodique) y español
(donde se emplean ambas denominaciones), al tratarse de una ordenación de los
elementos en filas y columnas.
Entre
otros ejemplos de investigadores que han destacado en la historia de la
construcción de la TP, se citan aquí algunos más, por su especial importancia.
En 1868 se descubrió el primer gas noble, helio, por las líneas espectrales de
la cromosfera del Sol. Supuso una gran contrariedad para Mendeléiev, pues no
había previsto un lugar adecuado en su TP. En 1895 el físico inglés Lord
Rayleigh descubrió el argón, en colaboración con el químico escocés William
Ramsay (Fig. 5). Este último descubrió tres años después otros tres gases
nobles (Kr, Ne y Xe). Finalmente, la existencia de los gases nobles (también
denominados inertes) fue una brillante confirmación de la ley periódica y
Mendeléiev los incluiría como grupo 0 en su TP. El químico y físico inglés
Frederick Soddy explicó la importancia del peso atómico ponderado (teniendo en
cuenta la proporción de cada isótopo) y fue quien acuñó el término “isótopo”5
[10]. El físico danés Niels Henrik David Bohr realizó contribuciones
fundamentales para la comprensión de la estructura del átomo y de la mecánica
cuántica, como el físico alemán Erwin Schrödinger. Más recientemente, a partir
de los años cuarenta del pasado siglo, el químico nuclear norteamericano Glenn T.
Seaborg colaboró activamente en el descubrimiento y aislamiento de diez elementos
transuránidos (de mayor número atómico que el uranio) que se añadieron a la TP
y son: Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No y Sg (este se denominó seaborgio en
su honor). Además, sugirió que tanto los lantánidos como los actínidos iban
completando los subniveles electrónicos “f” y no los “d” como se pensaba.
Fig.5. Litografía de
Ramsay realizada por el conocido caricaturista Leslie Ward, titulada
“Chemistry” (Vanity Fair, 1908).
En
la Fig. 6 se recoge un resumen de las teorías atómicas más relevantes,
realizado por el profesor Andy Brunning, muy conocido en los últimos años por
sus infografías sobre conceptos relacionados con la química [11]. La mecánica
cuántica, consolidada a finales de la década de los 20, aportaría la
explicación actual de la TP. Así, las propiedades de los elementos varían
periódicamente con el número atómico (número de protones del núcleo del átomo,
coincidente con su número de electrones) que, como se ha indicado, no es
proporcional al peso atómico (dependiente del número de protones pero también
del número de neutrones presentes en el núcleo atómico) en todos los casos. Los
electrones se distribuyen en orbitales atómicos con energía “cuantizada”, no
continua. La periodicidad no se produce para los mismos intervalos, sino
sucesivamente, cada 2, 8, 8, 18, 18, 32 y 32 unidades de número atómico. Las
propiedades se repiten aproximadamente al repetirse la disposición de los
electrones de la capa electrónica más externa (de valencia). Así, los
alcalinos, como el sodio y el potasio, poseen propiedades análogas, como la
formación de cationes M+, porque la configuración de su capa de
valencia es del tipo s1, mientras que los halógenos, como el flúor y
el cloro, tienen propiedades similares, como la formación de aniones X-,
porque su configuración es del tipo s2p5, o todos los
gases nobles son muy poco reactivos porque completan su capa de valencia (s2p6).
Esto
no es sencillo, pero su potencialidad didáctica es tan relevante que en muchos
países, como España, se aborda (desde hace décadas) en los currículos oficiales
para alumnos de unos 13 años de edad; en otros, se opta por enseñar una química
más macroscópica en la etapa introductoria y estos aspectos se tratan en cursos
superiores.
Formas de representar la tabla periódica.
La
labor del profesorado y de las editoriales de libros de texto en la evolución
de la TP ha sido crucial. El propio Mendeléiev se esforzó en clasificar los
elementos químicos con objeto de racionalizar el estudio de la química
inorgánica en un libro de texto. Parece ser que era muy aficionado a los juegos
de cartas de solitarios, con los que se entretenía en sus frecuentes viajes en
tren. Durante uno de estos, para visitar varias fábricas, preparó una carta
para cada elemento, donde anotó en cada una el peso atómico y propiedades
típicas; al ordenarlas por peso atómico, se convenció de que las propiedades
dependían periódicamente de los pesos atómicos.
En
la Fig. 7 se muestra la considerada como la TP educativa más antigua
conservada; se encontró de casualidad hace poco, en la Universidad de Saint
Andrews (Escocia) y se supone que data de alrededor de 1885. En la Fig. 8 se
muestra otro ejemplo de TP académica muy común en los años 30 en España, donde
se seguía el modelo propuesto en 1926 por el químico estonio Andreas von
Antropoff6. Aparte de la recogida en esta figura, conservada en el
I.E.S. San Isidro de Madrid, hay otra del tipo von Antropoff en formato mural
en la Universidad de Barcelona. Cada grupo se identifica con diferentes colores
(elegidos por alguna propiedad de los elementos correspondientes), mediante
barras de unión entrelazadas [12].
Fig.8. Tabla periódica
según el modelo de von Antropoff conservada en el I.E.S. San Isidro de Madrid.
(Fotografía realizada y remitida por las profesoras Mª. José Gómez y Rosario
Ramos, respectivamente).
Se
han ideado diferentes estructuras a lo largo de la historia a partir de la TP
inicial de Mendeléiev, colocando los elementos de formas variadas. Las familias
de elementos con propiedades similares, que en un principio se representaban en
filas, ahora (como ya hizo Mendeléiev en sucesivas actualizaciones) se recogen
en columnas. La forma más conocida y usada, que aparece en casi todos los
libros de texto y publicaciones actuales, es la alargada que se muestra en la
Fig. 9. En este modelo hay 7 periodos. A veces se incluye un octavo con solo
dos elementos, Uue (119) y Ubn (120), aún no descubiertos, y 18 columnas
numeradas de la 1 a la 18. Hace unos años, las columnas (familias de elementos)
se designaban por grupos IA a VIII A (elementos representativos) y de IB a
VIIB, más un VIII (que incluye los grupos del Ni, Fe y Co), para agrupar los
metales de transición. Algunos grupos tienen denominación especial, como gases
nobles, alcalinos, alcalinotérreos y halógenos.
Existen
aún ciertas discrepancias sobre algunos aspectos. Así, en algún caso se coloca
el He encima del Be, por ser la columna de las configuraciones electrónicas s2,
pero se suele ubicar encima del Ne, como típico gas noble que es. Con el H
ocurre algo similar; aunque se suele colocar encima del Li, porque ambos son de
configuración s1, a veces se dispone encima del F por presentar
propiedades más similares a las de los halógenos que a las de los metales
alcalinos. Existen muchas variedades de colores, que suelen representar tres
grandes familias de elementos: metales, no metales y semimetales (también
denominados metaloides). Pero también se usan colores, a veces, para distinguir
los elementos que se presentan como sólido, líquido o gas, en condiciones
especificadas de temperatura y presión, así como si se trata de elementos
sintéticos.
El
modelo de TP de 18 columnas se atribuye al químico norteamericano Horace G. Deming, que lo publicó en 1923. La empresa química y farmacéutica Merck la
distribuyó ampliamente por centros de enseñanza media de Estados Unidos desde
1928 y, en la década siguiente, se difundió en manuales y enciclopedias de
química por la empresa de material educativo Sargent-Welch.
Lo
mínimo que suele figurar en la casilla de cada elemento en las TP actuales es
su símbolo, nombre, número atómico y peso atómico, pero también se pueden
incluir otras muchas propiedades (electronegatividad, puntos de fusión y
ebullición, configuración electrónica, etc.).
Por
no realizar figuras de TP excesivamente anchas, los elementos de transición
interna (lantánidos y actínidos) se colocan generalmente en filas debajo de la
TP general, con varias versiones. En la mostrada en la Fig. 9, se han colocado
el La y el Ac (como primeros lantánidos y actínidos) debajo del Y. En otras, se
disponen en esas posiciones al Lu y al Lr (como últimos lantánidos y actínidos,
respectivamente). También existen versiones de TP donde lantánidos y actínidos
están insertados en la propia tabla principal, con lo que queda muy alargada.
La interpretación de estos ordenamientos está de acuerdo a las configuraciones
electrónicas de los elementos, de forma que, una vez se domina la cuestión, es
muy fácil entender qué configuración electrónica posee cada elemento, solo
observando dónde está ubicado en la TP.
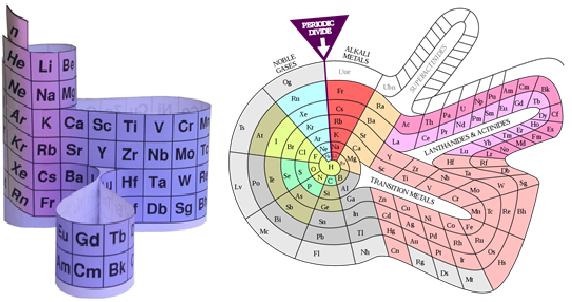
En
todo caso, ha habido, y sigue habiendo, multitud de propuestas menos
convencionales, mostrando muchas veces importantes dotes de creatividad. Entre
otras, se recogen dos ejemplos al respecto en la Fig. 10.
Fig.10. Propuestas de
tablas periódicas. Izq.: Por Roy Alexander (patentada en 1971), con forma
tridimensional. Der.: Por Theodor Benfey (1964), donde se agrupan los elementos
en una espiral con los metales de transición, lantánidos y actínidos formando
“penínsulas”.
Significado e interpretación de la tabla
periódica moderna.
Como se
ha indicado, podemos considerar la TP hoy en día como un reflejo de los
resultados de la física cuántica en cuanto a la interpretación de las
configuraciones electrónicas. Pero no conviene olvidar que también nos explica
con bastante precisión por qué las propiedades atómicas de los elementos varían
de forma periódica con el número atómico y, por tanto, con la posición que
ocupan los elementos en la TP. Dicho de otro modo, gracias a los estudios de
Mendeléiev y otros autores sobre cómo variaban las propiedades de los
elementos, y gracias a los avances sobre la comprensión de la estructura
atómica, se ha podido elaborar una TP de los elementos que nos permite razonar
e interpretar cómo varían muchas propiedades. Dado que el estudio de esto en
detalle excede los objetivos de este trabajo, se recomienda al lector
interesado que visite la página Web de la Royal
Society of Chemistry [13], que incluye también información para descargar
como app. Se incluye allí una TP interactiva donde se puede elegir una
presentación convencional de los elementos (con sus símbolos) o con imágenes.
En ella, se puede visualizar el estado físico de cada elemento (entre 0K y
6000K de temperatura), se incluyen una breve historia (incluso en formato podcast
y en vídeo) e información sobre el origen etimológico de cada elemento y, quizá
lo más interesante, se puede elegir una propiedad determinada (densidad, radio
atómico, electronegatividad, punto de fusión, punto de ebullición y energía de
la primera ionización) para apreciar de forma muy visual lo que significa la
periodicidad.
Otra
fuente de información muy relevante sobre la TP es la que se ofrece en la Web
con el título de Webelements [14],
que incluye incluso la posibilidad de comprar productos curiosos (modelos
moleculares, camisetas, accesorios, pósteres, etc. sobre el tema.
Como
ejercicio curioso, para ver si se conocen las posiciones de los elementos de la
TP, se sugiere que el lector advierta si identifica qué representan los
símbolos incluidos en la Fig. 11, donde se muestra una TP en chino. Otro
ejercicio que se recomienda es buscar las biografías de los personajes (y otros
relacionados con ellos) que aparecen en este capítulo e indagar sobre el origen
de los nombres de los elementos, que remiten a localidades, países,
científicos, propiedades, mitología, etc. [15].
Saber
sobre la TP no es una mera curiosidad; conociéndola bien y entendiendo acerca
de las variaciones periódicas que refleja, se puede justificar perfectamente
cómo se forma un semiconductor tipo “n” o “p”, por “dopado” de un elemento como
el Si o el Ge, se pueden valorar alternativas para sintetizar nuevos
superconductores de materiales cerámicos avanzados, se puede razonar el efecto
biológico de un catión u otro, o predecir qué elementos se forman por
desintegración radiactiva a partir de los núcleos de un elemento concreto, por
poner algunos ejemplos.
Contribución española a la construcción de la
tabla periódica.
La
aportación de nuestro país en la construcción de la TP no es menor: sólo hay
del orden de una decena de países cuyos científicos han descubierto 2 o más de
los elementos. Uno de ellos es España, con tres, como se resalta en el segundo
sello de la Fig. 1. En todo caso, a veces es difícil precisar quién descubre un
elemento químico: ¿La primera persona que lo detecta? ¿El primero que lo aísla?
¿El que lo caracteriza en primer lugar? Incluso, puede haber controversias
porque se realizó el descubrimiento en distintos sitios y los protagonistas
tuvieron diferente fortuna en la difusión de su conocimiento. Tampoco todos los
países actuales se corresponden con los de hace cien o doscientos años, ni
parece conveniente hacer de esta cuestión un ejercicio de nacionalismo. Pero sí
por cercanía y por honrar su labor, se recogen aquí, brevemente, algunos aspectos
de la participación española en la construcción de la TP.
El
único elemento cuyo nombre y símbolo tienen etimología española es el platino,
que descubrió el marino, aventurero y científico ilustrado Antonio de Ulloa y
de la Torre (Sevilla, 1716 – Isla de León, Cádiz, 1795). Con solo 19 años
participó, acompañado de Jorge Juan (Monforte del Cid, Alicante, 1713 – Madrid,
1773), en la Misión Geodésica
Hispano-francesa, que transcurrió durante nueve años principalmente por la Real Audiencia de Quito (hoy Ecuador),
para medir la longitud de un arco de meridiano y resolver así un problema de
geodesia sobre la esfericidad de la Tierra. Allí, Ulloa se dio cuenta de que
una impureza de oro y plata, que se denominaba “platina” por su similitud con
la plata, era un nuevo metal [16]. El wolframio fue descubierto en el Real Seminario Patriótico de Vergara por
los hermanos Elhuyar y Lubice: Juan José (Logroño, 1754 – Bogotá, 1796) y
Fausto Fermín (Logroño, 1755 – Madrid, 1833). Con formación europea, ambos desarrollaron
su carrera científica en América (Juan José en el Virreinato de Nueva Granada,
actual Colombia, y Fausto en el de Nueva España, actual México). Aunque la RAE
admite también la denominación de tungsteno, la comunidad de químicos españoles
suele preferir que se designe wolframio. Andrés Manuel del Río Fernández
(Madrid, 1764 – Ciudad de México, 1849) estudió en el Instituto (entonces Real Colegio) de San Isidro (ya
mencionado), en la Universidad de Alcalá, en la Escuela de Minería de Almadén y
en varios países europeos. Fue de profesor a México donde, aparte de
importantes logros en mineralogía, descubrió el elemento que se conocería como
vanadio.
Otras
aportaciones españolas, más recientes, son las de Blas Cabrera y Felipe
(1878-1945) en el estudio de las propiedades magnéticas de los átomos, las de
Enrique Moles Ormella (1883-1953), que llegó a ser secretario de la Comisión de Pesos Atómicos de la IUPAC,
y las de Miguel Antonio Catalán Sañudo (1894-1957), por su interpretación de la
configuración electrónica y la elaboración de una TP basada en los espectros
atómicos.
Dentro
de la celebración de 2019 como Año
Internacional de la TP, las actividades emprendidas en España han
alcanzando un eco internacional. Por ejemplo, en la fachada de la Facultad de
Química de la Universidad de Murcia se encuentra la considerada como la TP más
grande del mundo y su fotografía se incluye en la información aportada por la
IUPAC sobre la efeméride.
El futuro previsible de la tabla periódica.
Aparte
de ciertas controversias pendientes ya citadas, a la hora de elegir la
ubicación y disposición de algunos elementos en la TP, podemos afirmar que
están descubiertos los que constituyen, al menos, la materia accesible a
nosotros (no quedan “huecos” como en la propuesta inicial de Mendeléiev). Hay
que destacar aquí que, a partir del uranio (de número atómico 92) los
siguientes elementos (transuránidos) son sintéticos e inestables, con una vida
media tan pequeña que no cabe pensar en la preparación de sustancias de interés
cotidiano, aunque sí muy relevantes desde el punto de vista de la física
nuclear (incluyendo aplicaciones médicas). Para los elementos de número atómico
119 y 120, que aún no se han obtenido y que, provisionalmente, la IUPAC les
asigna los símbolos de Uue (ununennium) y Ubn (unbinilium), por la forma de
citar en latín sus números atómicos, respectivamente, es de esperar que sigan
el procedimiento actual de asignación de nombre cuando se admita su autoría: la
IUPAC da un tiempo para que los investigadores protagonistas del descubrimiento
(hoy en día centros de investigación y no investigadores actuando de forma
aislada) propongan un nombre relacionado con términos geográficos, nombres de
científicos, un concepto o personaje mitológico (incluyendo objetos astronómicos),
un mineral o sustancia similar, o una propiedad del elemento. Así se nominaron
en 2016 los últimos elementos: nihonio (113), moscovio (115), teneso (117) y
oganesón (118). Ojalá alguna vez se sugiera el nombre de algún científico
español, por ejemplo los citados en este texto. El geólogo inglés George W.
Featherstonhaugh, que desarrolló su labor en Estados Unidos, sugirió que el
vanadio se nombrase “rionio” en honor a su descubridor, pero nunca se ha
considerado la idea. También merecen reconocimiento, en cuanto a nomenclatura
de elementos, personajes como Lavoisier, Dalton, Faraday y Moseley, entre
otros, y sería positivo atender a otras zonas geográficas: no parece justo que
los países con más recursos y, por tanto, con una investigación más avanzada y
consolidada, acaparen los nombres de los elementos.
Además
de la propia nomenclatura, cuando se inicie el descubrimiento del elemento de
número atómico 121 y posteriores, nos encontraremos con el mismo problema que
la ubicación de los lantánidos y actínidos en la TP. A partir de ese elemento,
se inician previsiblemente las configuraciones electrónicas con 9 orbitales g
(en los que puede haber 18 electrones y, consecuentemente, ese mismo número de
elementos). Es probable que se aborde, en su día, incluyéndolos debajo de los
actínidos, también fuera de la tabla general.
De
cualquier forma, la creatividad y los avances científicos igual consiguen que,
dentro de un tiempo, alguien tenga la genialidad de ordenar los elementos de
otro modo, atendiendo siempre a su periodicidad, aprovechando quizá la
versatilidad de las herramientas digitales.
A modo de conclusión.
La
historia de la construcción de la TP es un ejemplo de cómo se desarrolla la
ciencia, una obra colectiva e internacional. El resultado es apasionante; es
difícil imaginar en cualquier área del saber otro esquema tan fundamentado y
con tanta información útil recogida en una tabla que entra en una hoja. Este
icono universal no sólo es historia; es clave para entender muchos avances y
progresos en multitud de áreas, como la física nuclear, la ciencia de los
materiales, la biomedicina, etc.
Dada
la limitación por las características de este texto, no se ha profundizado en
muchos aspectos. Para lectores con deseos de seguir introduciéndose en el tema
se recomiendan, aparte de los textos recogidos en las referencias, dos libros:
el de Oliver Sacks [17], donde explica el atractivo que le supuso la tabla
periódica en su infancia, aunque profesionalmente se dedicó, ya de adulto, a la
neurología, y el de Theodore Gray, con fotografías espectaculares sobre los
elementos químicos y sus aplicaciones realizadas por Nick Mann y él mismo, que
se recogen también en una página Web [18].
Ojalá
la celebración del Año Internacional de la Tabla Periódica, en el
sesquicentenario de la propuesta inicial de Mendeléiev, sirva para que se
conozca más, especialmente por niños y jóvenes, esta joya de la humanidad, no
siempre suficientemente valorada. Además, es buena ocasión para conocer y
destacar la labor de la IUPAC, especialmente en la definición de la
nomenclatura química, con ocasión de su centenario.
Referencias:
[1]
International Union of Pure and Applied Chemistry (IUPAC). The international year
of the Periodic Table: A common language for science. https://www.iypt2019.org/
[2]
Pinto G. 2007. A postage stamp about the periodic table. Journal of Chemical Education84: 1919.
[3]
Pinto, G. 2018. Modelos atómicos y propiedades periódicas de los elementos
químicos: Recursos para el aprendizaje. Alambique,
Didáctica de las Ciencias Experimentales 93: 41-45.
[4]
Pinto Cañón, G.; Castro Acuña, C. M.; Martínez Urreaga, J. Ed. 2006. Química al
alcance de todos. Madrid. Pearson Alhambra.
[5]
Pinto, G.; Martín, M.; Calvo Pascual, M. A.; de la Fuente, A. 2019. Año internacional
de la tabla periódica (2019): Una oportunidad para abordar contextos de didáctica
e historia de la física y la química. Revista
Española de Física, en prensa.
[6]
Scerri, E. Ed. 2013. La tabla periódica: Una breve introducción. Madrid. Alianza
Editorial.
[7]
Esteban Santos, S. Ed. 2009. La historia del sistema periódico. Madrid. Cuadernos
de la UNED.
[8]
Moeller, T. Ed. 1959. 3ª edición. Química inorgánica. Barcelona. Reverté.
[9]
Román Polo, P. Ed. 2002. Mendeléiev: El profeta del orden químico. Tres Cantos
(Madrid). Nivola Libros y Ediciones.
[10]
Soddy, F. 1913. Intra-atomic charge. Nature
92: 399-400.
[11]
Brunning, A. Compound Interest. https://www.compoundchem.com/
[12]
Mans, C. 2010. La tabla periódica del edificio histórico de la Universidad de
Barcelona. Química e Industria 587:
36-40.
[13]
Royal Society of Chemistry (RSC). Periodic table. http://www.rsc.org/periodic-table/
[14]
Winter, M. Webelements: The periodic table on the WWW. https://www.webelements.com/
[15]
Román Polo, P. 2018. Los nombres de los elementos químicos desde el siglo XVIII
hasta nuestros días. En Ruiz-Berdún, D. (Ed.). Ciencia y Técnica en la
Universidad: Trabajos de historia de las ciencias y de las técnicas, Vol. I.
Universidad de Alcalá: Servicio de Publicaciones, pp. 173-184.
[16]
Pinto G. 2017. Antonio de Ulloa and the discovery of platinum: An opportunity
to connect science and history through a postage stamp. Journal of Chemical Education 94: 970-975.
[17]
Sacks, O. 2006. El tío Tungsteno: Recuerdos de un químico precoz. Madrid.
Anagrama.
[18]
Gray, T. 2009. The elements: A visual exploration of every known atom in the
universe. Nueva York. Black Dog & Leventhal Publishers. Con información
complementaria (imágenes, vídeos, etc. de los elementos) en: http://periodictable.com/theelements/pages.html
Gabriel Pinto Cañón
Doctor
en Ciencias Químicas (especialidad de Química Física) por la Universidad Complutense de Madrid.
Catedrático
de Universidad (área de Ingeniería Química) en la Universidad Politécnica de Madrid.
Presidente
del Grupo Especializado de Didáctica e
Historia, común a las Reales
Sociedades Españolas de Física y de Química.
Scientix Ambassador.
Notas:
1 Paracelso es el pseudónimo que eligió para sí mismo
Theophrastus Bombast von Hohenheim, por considerarse “semejante a Celso” (autor
romano de libros de medicina del siglo I). Tuvo mucha fama porque se pensaba
que consiguió la “transmutación” del plomo en oro. Destacó en toxicología,
donde es conocida su sentencia “dosis sola
facit venenum” (la dosis hace al veneno).
2 El peso atómico
de la época (inicialmente referido por el concepto químico, hoy en desuso, de
“equivalente”) se conoce actualmente como masa
atómica relativa. Las diferencias sobre el significado de este tipo de
conceptos conllevan cierta controversia. Otro ejemplo del cuidado que hay que
prestar al significado y evolución histórica de conceptos es la diferenciación
entre valencia (término introducido a finales del siglo XIX para designar el
“poder de combinación” de un elemento), carga formal y número de oxidación.
3 El apellido Reina se debe al origen italiano de su madre.
Newlands participó como voluntario con Giuseppe Garibaldi en la conquista del
reino de Nápoles (1860) para la reunificación italiana.
4 Moseley falleció con solo 27 años en la batalla de
Galípoli (Turquía, 1915) en la Primera Guerra Mundial. Su aportación fue
fundamental para la comprensión de la estructura atómica y de la TP.
5 Creó un neologismo basado en las palabras griegas isos (igual) y topos (lugar), refiriéndose a átomos con igual número de protones
(número atómico) y distinta masa atómica (por poseer diferente número de
neutrones). Explicó que los denominó isótopos o elementos isotópicos, por
ocupar el mismo lugar en la TP y ser químicamente idénticos.
6 Doctorado en Heidelberg
(Alemania), se formó con Ramsay en Londres y fue profesor en San Petersburgo.
Tras ser arrestado en 1918 por el Soviet de Petrogrado, pasó a trabajar en la
Universidad de Bonn, donde llegó a decano y destacó por ser un
nacionalsocialista convencido.Añadido el 16-04-2024 por Quintín Garrido (Coordinador)











Un artículo estupendo y muy ameno, Gabriel.
ResponderEliminarMuy honrado por tu comentario, Emilio. Porque fuiste mi profesor de Prácticas de Química Inorgánica en la UCM, en el curso 81/82.
EliminarEnhorabuena, Gabriel. Excelente artículo. Me ha gustado mucho.
ResponderEliminarPor favor, corrige: G. T. Seaborg fue un químico nuclear norteamericano... Fuente: Encyclopaedia Britannica. "American nuclear chemist best known for his work on isolating and identifying transuranium elements (those heavier than uranium)." [https://bit.ly/2p0di4q]
Gracias de nuevo Pascual.
EliminarYa está corregido, gracias a la diligencia de Quintín, el artífice de esta iniciativa.
Hola no lo entiendo
ResponderEliminar